Metody modulacji mikrobioty jelitowej na wczesnych etapach życia
Abstrakt
Wstęp: Mikrobiota jelitowa, czy też mikrobiom, to niezbędny element ludzkiego zdrowia. Jej skład kształtują czynniki na wczesnych etapach życia, takie jak: droga porodu, dieta oraz stosowanie antybiotyków, tym samym wpływając krótko- i długoterminowo na zdrowie. Dysbioza (czyli zmiany w mikrobiocie jelitowej) jest związana ze schorzeniami, takimi jak alergie, astma, otyłość, cukrzyca, nieswoiste zapalenie jelit oraz martwicze zapalenie jelit u niemowląt urodzonych przedwcześnie.
Streszczenie: Artykuł ten dokonuje przeglądu obowiązujących strategii modulacji mikrobiomu jelitowego na wczesnych etapach życia oraz ich potencjalnego wpływu na zdrowie. Publikacja także pokrótce podsumowuje wytyczne na temat stosowania biotyków w chorobach alergicznych i przewodu pokarmowego u dzieci. Do kluczowych strategii należą: przeszczepy mikrobioty przewodu pokarmowego lub pochwy u niemowląt urodzonych poprzez cesarskie cięcie, karmienie piersią oraz stosowanie preparatów do żywienia niemowląt z dodatkiem biotyków. Mimo, iż transfer mikrobioty pochwowej oraz przeszczep fekalnej mikrobioty wykazują krótkoterminowe korzyści, potrzeba dalszych badań, by określić ich długotrwałe bezpieczeństwo i skuteczność. Pokarm matki, bogaty w oligosacharydy mleka kobiecego, wspiera prawidłową mikrobiotę i zapewnia ochronę przeciwko infekcjom. Preparaty do żywienia niemowląt z dodatkiem biotyków mogą poprawiać stan mikrobioty u niemowląt karmionych mlekiem modyfikowanym. Preparaty te wykazują skuteczność kliniczną, jednak każdy z biotyków powinien być rozważany oddzielnie. Probiotyki, stosowane jako suplement diety, wykazują potencjał w leczeniu zaburzeń przewodu pokarmowego, jednak wymagają dalszych badań.
Wprowadzenie
Mikrobiota jelitowa, określana jako mikrobiom (w Tabeli 1 wyjaśniono podstawowe pojęcia tego rozdziału), gra krytyczną rolę w zdrowiu człowieka, szczególnie na wczesnych etapach życia. Różne czynniki (Ryc. 1) kształtują skład mikrobioty jelitowej w pierwszych miesiącach życia [1]. Zmiany w składzie i funkcjonowaniu mikrobioty, określane jako dysbioza, są powiązane z wyższym ryzykiem wystąpienia alergii, astmy, otyłości, cukrzycy, nieswoistego zapalenia jelit oraz martwiczego zapalenia jelit u niemowląt urodzonych przedwcześnie. Jednakże, istnieją wątpliwości wobec adekwatności pojęcia dysbiozy, ponieważ trudno jest jednoznacznie określić, co stanowi "nieprawidłowość" bez wcześniejszego ustalenia definicji "prawidłowości" [2]. Aktywna modulacja mikrobioty jelitowej, począwszy od wczesnych etapów życia, może wpływać na krótko- i długotrwałe efekty zdrowotne. Artykuł ten dokonuje przeglądu współczesnych strategii wpływania na mikrobiom jelitowy we wczesnym okresie życia oraz ich potencjalnego wpływu na zdrowie. Publikacja także pokrótce podsumowuje wytyczne na temat stosowania biotyków w chorobach alergicznych i przewodu pokarmowego u dzieci.

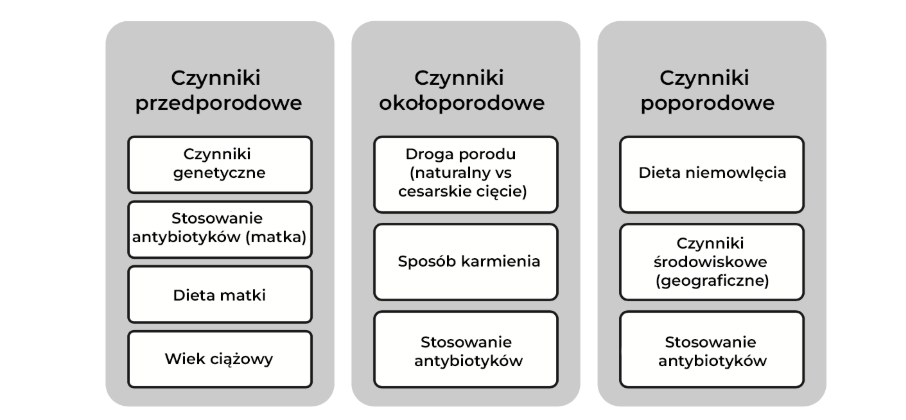
Ryc. 1. Wybrane czynniki wpływające na mikrobiotę jelitową niemowlęcia.
Metody modulacji mikrobiomu
Transfer mikrobioty pochwowej lub kałowej u niemowląt urodzonych przez cesarskie cięcie
Mikrobiom niemowląt urodzonych przez cesarskie cięcie różni się od tych urodzonych drogami natury oraz jest powiązany z wyższym ryzykiem chorób. Transfer mikrobioty pochwy (VMT) oraz matczyny transfer mikrobioty przewodu pokarmowego (mFMT) polegają na transferze mikrobioty od zdrowego dawcy do niemowlęcia, aby zapewnić prawidłowy rozwój mikrobiomu. Przegląd systematyczny z 2024 roku [3] uwzględnił sześć badań, w których wykazano krótkotrwałe korzyści, choć wpływ długoterminowy pozostaje wątpliwy z racji na ograniczone badania kontrolne. Tylko dwa badania randomizowane (ang. RCT - randomized controlled trial) uwzględniały klinicznie istotne wyniki. Jedno z tych badań autorstwa Zhou i wsp. [4] z udziałem 68 matek po cesarskim cięciu wykazało, że rozwój neurologiczny, oceniany za pomocą Ages and Stages Questionnaire (ASQ-3) w 6. miesiącu życia był na istotnie wyższym poziomie w grupie po VMT, w porównaniu z grupą kontrolną. Ponadto, nie wykazano istotnej różnicy między grupami w kontekście skutków ubocznych, co wskazuje na bezpieczeństwo VMT. W badaniu stwierdzono, że VMT może częściowo zwracać rozwój neurologiczny oraz mikrobiom kałowy w kierunku normalnego u niemowląt urodzonych przez cesarskie cięcie. Kolejne badanie RCT autorstwa Liu i wsp. [5] z udziałem 120 niemowląt nie wykazało istotnego wpływu przenoszenia mikrobioty pochwowej (ang. vaginal seeding) na mikrobiotę jelitową, wzrost (BMI) oraz ryzyko alergii w pierwszych 2. latach.
Wspólnie, VMT i zasiedlanie mikrobiotą pochwy (vaginal seeding) wykazują potencjał w częściowej zmianie mikrobioty jelitowej w kierunku normalnej oraz poprawie niektórych efektów zdrowotnych u niemowląt urodzonych przez cesarskie cięcie, jednak ich długotrwałe korzyści oraz bezpieczeństwo wymagają dalszych badań. Obecnie dostępna literatura sugeruje, iż te interwencje są bezpieczne i mogą nieść krótkotrwałe korzyści, jednak by zrozumieć ich wpływ oraz bezpieczną implementacje, potrzeba wystandaryzowanych protokołów oraz dużych, długoterminowych badań. Trwające badania (NCT03298334, NCT02567071, NCT04173208) być może dostarczą jednoznacznych wniosków na temat skuteczności i bezpieczeństwa tychże praktyk.
Dieta: Pierwsze jedzenie ma znaczenie
Niezależnie od tego, czy wybiera się wyłączne, czy częściowe karmienie piersią, podawanie mleka matki stanowi istotny czynnik wpływający na skład mikrobiomu [6]. Kluczowymi składnikami mleka kobiecego są oligosacharydy mleka kobiecego (ang. HMOs - human milk oligosaccharides) [7]-węglowodany złożone, składające się z pięciu monosacharydów: glukozy, galaktozy, N-acetyloglukozaminy, fukozy i kwasu sjalowego. Biorąc pod uwagę zawartość, HMO są trzecim najliczniejszym stałym składnikiem pokarmu kobiecego, zaraz po laktozie i tłuszczu. Szacuje się, że mleko matki zawiera około 150-200 HMO o odmiennej strukturze, jednak dokładna liczba jest wciąż nieznana. Oligosacharydy mleka kobiecego nie niosą za sobą bezpośredniej wartości odżywczej dla niemowlęcia, ale służą przede wszystkim jako prebiotyk, dzięki czemu wspierają prawidłowe kształtowanie składu mikrobioty jelitowej. Są one selektywnym źródłem pożywienia dla specyficznych drobnoustrojów, głównie Bifidobacterium infantis (B. infantis), B. bifidum oraz B. breve, które zasiedlają przewód pokarmowy [8]. Karmienie piersią niesie za sobą wiele korzyści, prawdopodobnie modulowanych przez mikrobiotę jelitową. Do korzyści tych zaliczamy: skuteczniejszą ochronę przed infekcjami, zmniejszone wskaźniki umieralności i niedożywienia oraz niższe ryzyko otyłości w późniejszym życiu [9].
Karmienie piersią niesie za sobą wiele korzyści, prawdopodobnie modulowanych
przez mikrobiotę jelitową
Wraz z rozpoczęciem rozszerzania diety i stopniowym przejściem na pokarmy rodzinne, różnorodność drobnoustrojów w jelitach wzrasta, wprowadzając szczepy związane z dojrzałą mikrobiotą, takie jak Lachnospiraceae oraz Ruminococcaceae. Ten wzrost różnorodności w różnych ludzkich populacjach wskazuje na prawidłowy rozwój mikrobioty jelitowej. Kluczowym wyzwaniem w tym zakresie jest wyznaczenie optymalnego momentu dla odstawiania od piersi na rzecz wprowadzania żywności ze stołu rodzinnego, które jest niezbędne dla wzmacniania mikrobioty, dojrzewania odporności oraz długotrwałych efektów zdrowotnych [10].
Preparaty do żywienia niemowląt z dodatkiem biotyków
Dodatek biotyków, takich jak probiotyki [11], prebiotyki [12], synbiotyki [13] i postbiotyki [14] do preparatów do żywienia niemowląt ma na celu zawężenie luki między efektami zdrowotnymi karmienia piersią, a preparatami dla niemowląt. Przegląd systematyczny z 2024 roku [15] rozpatrujący 32 badania RCT opublikowane między 2010 a 2021 rokiem analizował wpływ biotyków na mikrobiotę jelitową (główny punkt końcowy) oraz inne efekty zdrowotne u niemowląt karmionych wyłącznie preparatami do żywienia niemowląt. W przeglądzie stwierdzono, iż prebiotyki ogólnie zwiększały ilość Bifidobacterium i zmniejszały ilość Clostridioides difficile w kale, jednak wyniki były zmienne w zależności od zastosowanego prebiotyku. Dodatek probiotyków zazwyczaj zwiększał ilość Lactobacillus w kale, ale nie wpływał jednoznacznie na wyniki metaboliczne, ani na cechy stolca. Synbiotyki zazwyczaj zwiększały ilość Bifidobacterium w kale i obniżały pH stolca, co prowadziło do rozluźnienia stolców i zwiększenia ich częstotliwości, jednak ich stosowanie miało znikomy wpływ na inne wyniki, takie jak ulewania. Wszystkie interwencje były dobrze tolerowane i nie zaobserwowano istotnych efektów ubocznych.
Obecnie, zespół specjalny ESPGHAN (European Society for Paediatric Gastroenterology, Hepatology and Nutrition) do spraw modyfikacji mikrobioty jelitowej (SIG-GMM) aktywnie aktualizuje dane na temat wszystkich biotyków (probiotyków, prebiotyków, synbiotyków, postbiotyków i analogów HMO) w preparatach do żywienia niemowląt, z naciskiem na wyniki istotne klinicznie.
Rekomendacje mogą zostać sformułowane dopiero, gdy będą dostępne co najmniej dwa badania RCT dotyczące pokrewnego, zdefiniowanego biotyku. Nie można wydać rekomendacji, gdy dostępne jest tylko jedno badanie RCT (niezależnie od jego wyników), gdy nie zapewniono specyfikacji danego biotyku lub gdy nie da się go zidentyfikować. Na podstawie innych podsumowań [16-20] stwierdzono, że preparaty dla niemowląt z dodatkiem biotyków są bezpieczne, dobrze tolerowane i wspierają prawidłowy wzrost. Wykazują także efekty kliniczne, takie jak: rzadsze stosowanie antybiotyków oraz rzadsze występowanie kolki. Jednakże, każdy z biotyków musi być rozważany osobno. Pomimo potencjału, jaki wykazują preparaty dla niemowląt z dodatkiem biotyków, dostępna literatura ma swoje ograniczenia. Różnice w stosowanych dawkach biotyków utrudniają wyciągnięcie jednoznacznych wniosków. Ponadto, długofalowe efekty takich interwencji pozostają nieznane z racji na często ograniczone badania kontrolne. Interpretacja wyników jest utrudniona także przez brak wystandaryzowanych protokołów i heterogeniczność schematów badań. Istnieje potrzeba większej ilości rygorystycznych, długoterminowych badań o ustandaryzowanej metodologii, aby w pełni zrozumieć potencjalne korzyści i ryzyka stosowania preparatów do żywienia niemowląt z dodatkiem biotyków.
Biotyki w chorobach przewodu pokarmowego
Poza dodawaniem ich do preparatów mlekozastępczych, biotyki są także stosowane jako suplementy diety lub, rzadziej, jako preparaty farmaceutyczne. Stosując wyżej wymienione zasady, grupa ESPGHAN SIG-GMM stworzyła rekomendacje stosowania różnych biotyków w zaburzeniach przewodu pokarmowego u dzieci [21-23]:
- Probiotyki: w ostrym nieżycie żołądkowo-jelitowym, zaleca się probiotyki takie jak: Saccharomyces boulardii, Lacticaseibacillus rhamnosus GG (wcześniej Lactobacillus rhamnosus), Limosilactobacillus reuteri DSM 17938 (wcześniej Lactobacillus reuteri), L. rhamnosus 19070-2 oraz L. reuteri DSM 12246. Aby zapobiec biegunce poantybiotykowej, rekomenduje się L. rhamnosus GG i S. boulardii. W prewencji biegunki szpitalnej sugeruje się podawanie L. rhamnosus GG w trakcie pobytu. U niemowląt urodzonych przedwcześnie z grupy ryzyka martwiczego zapalenia jelit zaleca się L. rhamnosus GG ATCC53103 lub połączenie B. infantis Bb-02, B. lactis BB-12 oraz Streptococcus thermophilus TH-4. U dzieci z zakażeniem Helicobacter pylori sugeruje się szczep S. boulardii. Nie ma probiotycznych zaleceń w chorobie Leśniowskiego-Crohna ani we wrzodziejącym zapaleniu jelit. W zapaleniu zbiornika jelitowego zaleca się mieszankę 8 szczepów probiotycznych. W przypadkach czynnościowego bólu brzucha, w tym zespołu drażliwego jelita, sugeruje się L. reuteri DSM 17938 lub L. rhamnosus GG. Na kolkę niemowlęcą rekomenduje się L. reuteri DSM 17938 lub B. lactis BB-12. Nie zaleca się probiotyków na zaparcia czynnościowe. Brakuje jednoznacznych zaleceń lub też przeciwwskazań dla stosowania probiotyków w przeroście bakteryjnym jelita cienkiego (SIBO) oraz w zapaleniu trzustki [21].
- Prebiotyki: babka płesznik jest rekomendowana przy zespole jelita drażliwego z niską pewnością dowodów. Brakuje zaleceń dla kolki niemowlęcej, zaparć czynnościowych, ostrego nieżytu żołądkowo-jelitowego, zakażenia H. pylori, nieswoistego zapalenia jelit, celiakii oraz martwiczego zapalenia jelita ze względu na niewystarczające dowody naukowe [22].
- Synbiotyki: nie ma zaleceń za ani przeciw stosowaniu przy ostrym nieżycie żołądkowo-jelitowym, zakażeniu H. pylori, nieswoistym zapaleniu jelit, kolce niemowlęcej, czynnościowym bólu brzucha i zaparciach czynnościowych, ze względu na niewystarczające dowody naukowe [23].
Biotyki w profilaktyce oraz leczeniu alergii pokarmowych
Dane naukowe wskazują na związek między składem mikrobioty jelitowej a rozwojem różnych alergii, w szczególności pokarmowych. Badania wykazały, że różnorodna i zrównoważona mikrobiota może zwiększać tolerancję immunologiczną, zmniejszając ryzyko reakcji alergicznych. Z drugiej strony, zaburzoną równowagę lub brak różnorodności wśród drobnoustrojów jelitowych powiązano z podwyższonym prawdopodobieństwem rozwoju alergii [24]. Mimo, iż istnieją przesłanki ku stosowaniu biotyków w prewencji alergii, Europejska Akademia Alergologii i Immunologii Klinicznej nie sformułowała żadnych rekomendacji za ani przeciw używaniu obecnie przebadanych probiotyków, prebiotyków, czy synbiotyków u kobiet w ciąży, karmiących piersią oraz u niemowląt [25]. W tej sytuacji pracownicy ochrony zdrowia powinni wspierać rodziny w zestawieniu korzyści i ryzyka tychże możliwości. Obecnie, żaden z biotyków nie jest rekomendowany w leczeniu alergii pokarmowych [26].
Wnioski
Jeżeli doszukiwać się prawdy w słynnym stwierdzeniu Hipokratesa: "Wszystkie choroby zaczynają się w jelitach", to w takim razie zdrowie także ma swój początek w jelitach. W tym kontekście, kluczowym jest zastosowanie zasady "po pierwsze - nie szkodzić". Reguła ta podkreśla potrzebę praktyk medycznych, które zachowują proces pierwotnego rozwoju mikrobioty niemowląt. Szczególnie ważne jest wspieranie karmienia piersią, ograniczanie niepotrzebnych cesarskich cięć oraz ograniczanie stosowania antybiotyków podczas porodu i okresu noworodkowego. Są jednak sytuacje, gdy samo unikanie ryzyka nie wystarczy. W takich wypadkach, aktywna modulacja mikrobioty we wczesnych latach życia wykazuje istotny potencjał w prewencji chorób.
Bibliografia
Reprint w Annales Nestle za pozwoleniem: Reprint za pozwoleniem:
Ann Nutr Metab 2025;81(suppl 1):28–33
1. Suárez-Martínez C, Santaella-Pascual M, Yagüe-Guirao G, Martínez-Graciá C. Infant gut microbiota colonization: influence of prenatal and postnatal factors, focusing on diet. Front Microbiol. 2023;14:1236254. https://doi.org/10.3389/fmicb.2023.1236254
2. Britton RA, Verdu EF, Di Rienzi SC, Reyes Munoz A, Tarr PI, Preidis GA. Biotherapeutics subcommittee of the AGA center for gut microbiome research and education. Taking microbiome science to the next level: recommendations to advance the emerging field of microbiome-based therapeutics and diagnostics. Gastroenterology. 2024;28(24):S0016–5085. https://doi.org/10.1053/j.gastro.2024.05.023
3. Liu S, Luo X, Zhou L, Xie RH, He Y. Microbiota transplantation in restoring cesarean-related infant dysbiosis: a new frontier. Gut Microbes. 2024;16(1):2351503. https://doi.org/10.1080/19490 976.2024.2351503
4 Zhou L, Qiu W, Wang J, Zhao A, Zhou C, Sun T, et al. Effects of vaginal microbiota transfer on the neurodevelopment and microbiome of cesarean-born infants: a blinded randomized controlled trial. Cell Host Microbe. 2023;31(7):1232–47.e5. https://doi.org/10.1016/j.chom.2023.05.022
5 Liu Y, Li HT, Zhou SJ, Zhou HH, Xiong Y, Yang J, et al. Effects of vaginal seeding on gut microbiota, body mass index, and allergy risks in infants born through cesarean delivery: a randomized clinical trial. Am J Obstet Gynecol MFM. 2023;5(1):100793. https://doi.org/10.1016/j.ajogmf.2022.100793
6 Stewart CJ, Ajami NJ, O'Brien JL, Hutchinson DS, Smith DP, Wong MC, et al. Temporal development of the gut microbiome in early childhood from the TEDDY study. Nature. 2018;562(7728):583–8. https://doi.org/10.1038/s41586-018-0617-x
7 Walsh C, Lane JA, van Sinderen D, Hickey RM. Human milk oligosaccharides: shaping the infant gut microbiota and supporting health. J Funct Foods. 2020;72:104074. https://doi.org/10.1016/j.jff.2020.104074
8 Jost T, Lacroix C, Braegger C, Chassard C. Impact of human milk bacteria and oligosaccharides on neonatal gut microbiota establishment and gut health. Nutr Rev. 2015;73(7):426–37. https://doi.org/10.1093/nutrit/nuu016
9 Victora CG, Bahl R, Barros AJ, França GV, Horton S, Krasevec J, et al. Breastfeeding in the 21st century: epidemiology, mechanisms, and lifelong effect. Lancet. 2016;387(10017):475–90. https://doi.org/10.1016/S0140-6736(15)01024-7
10 Laursen MF, Bahl MI, Michaelsen KF, Licht TR. First foods and gut microbes. Front Microbiol. 2017;8:356. https://doi.org/10.3389/fmicb.2017.00356
11 Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B, et al. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol. 2014;11(8):506–14. https://doi.org/10.1038/nrgastro.2014.66
12 Gibson GR, Hutkins R, Sanders ME, Prescott SL, Reimer RA, Salminen SJ, et al. Expert consensus document: the International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat Rev Gastroenterol Hepatol. 2017;14(8):491–502. https://doi.org/10.1038/nrgastro.2017.75
13 Swanson KS, Gibson GR, Hutkins R, Reimer RA, Reid G, Verbeke K, et al. The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of synbiotics. Nat Rev Gastroenterol Hepatol. 2020;17(11):687–701. https://doi.org/10.1038/s41575-020-0344-2
14 Salminen S, Collado MC, Endo A, Hill C, Lebeer S, Quigley EMM, et al. The International Scientific Association of Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of postbiotics. Nat Rev Gastroenterol Hepatol. 2021; 18(9):649–67. https://doi.org/10.1038/s41575-021-00440-6
15 Ferro LE, Crowley LN, Bittinger K, Friedman ES, Decker JE, Russel K, et al. Effects of prebiotics, probiotics, and synbiotics on the infant gut microbiota and other health outcomes: a systematic review. Crit Rev Food Sci Nutr. 2023;63(22):5620–42. https://doi.org/10.1080/10408398.2021.2022595
16 Braegger C, Chmielewska A, Decsi T, Kolacek S, Mihatsch W, Moreno L, et al. Supplementation of infant formula with probiotics and/or prebiotics: a systematic review and comment by the ESPGHAN committee on nutrition. J Pediatr Gastroenterol Nutr. 2011;52(2):238–50. https://doi.org/10.1097/MPG.0b013e3181fb9e80
17 Szajewska H, Kołodziej M, Skórka A, Pieścik-Lech M. Infant formulas with postbiotics: an updated systematic review. J Pediatr Gastroenterol Nutr. 2022;74(6):823–9. https://doi.org/10.1097/MPG.0000000000003441
18 Skórka A, Pieścik-Lech M, Kołodziej M, Szajewska H. To add or not to add probiotics to infant formulae? An updated systematic review. Benef Microbes. 2017;8(5):717–25. https://doi.org/10.3920/BM2016.0233
19 Skórka A, Pieścik-Lech M, Kołodziej M, Szajewska H. Infant formulae supplemented with prebiotics: are they better than unsupplemented formulae? An updated systematic review. Br J Nutr. 2018;119(7):810–25. https://doi.org/10.1017/S0007114518000120
20 Lemoine A, Tounian P, Adel-Patient K, Thomas M. Pre-pro-syn and postbiotics in infant formulas: what are the immune benefits for infants? Nutrients. 2023;15(5):1231. https://doi.org/10.3390/nu15051231
21 Szajewska H, Berni CR, Domellöf M, Guarino A, Hojsak I, Indrio F, et al. Position paper of the ESPGHAN special interest group on gut microbiota and modifications. J Pediatr Gastroenterol Nutr. 2023; 76(2):232–47. https://doi.org/10.1097/MPG.0000000000003633
22 Indrio F, Dinleyici EC, Berni Canani R, Domellöf M, Francavilla R, Guarino A, et al. Prebiotics in the management of pediatric gastrointestinal disorders: position paper of the ESPGHAN special interest group on gut microbiota and modifications. J Pediatr Gastroenterol Nutr. 2024;78(3):728–42. https://doi.org/10.1002/jpn3.12134
23 Hojsak I, Kolaček S, Mihatsch W, Mosca A, Shamir R, Szajewska H, et al. Synbiotics in the management of pediatric gastrointestinal disorders: position paper of the ESPGHAN special interest group on gut microbiota and modifications. J Pediatr Gastroenterol Nutr. 2023;76(1):102–8. https://doi.org/10.1097/MPG.0000000000003568
24 Hoskinson C, Dai DLY, Del Bel KL, Becker AB, Moraes TJ, Mandhane PJ, et al. Delayed gut microbiota maturation in the first year of life is a hallmark of pediatric allergic disease. Nat Commun. 2023;14(1):4785. https://doi.org/10.1038/s41467-
023-40336-4
25 Halken S, Muraro A, de Silva D, Khaleva E, Angier E, Arasi S, et al. EAACI guideline: preventing the development of food allergy in infants and young children (2020 update). Pediatr Allergy Immunol. 2021;32(5):843–58. https://doi.org/10.1111/pai.13496
26 Muraro A, de Silva D, Halken S, Worm M, Khaleva E, Arasi S, et al. Managing food allergy: GA2LEN guideline 2022. World Allergy Organ J. 2022;15(9):100687. https://doi.org/10.1016/j.waojou.2022.100687
Jeśli podobała Ci się ta publikacja, może Ci się również spodobać